
|
●平成28年(行ケ)第10182号(審決取消訴訟・請求棄却)
進歩性/特許出願/ピリミジン誘導体
| [事件の概要] |
|
本件は、特許無効審判請求を不成立とする審決の取消訴訟です。 争点は、訴えの利益の有無、進歩性の有無及びサポート要件違反の有無ですが、以下、進歩性に関する事柄だけを紹介します。 訴えの利益に関しては、次を参照して下さい。 →訴えの利益のケーススタディ3 [事件の経緯] (a)被告乙は、 平成4年5月28日に、国内優先権(優先日:平成3年7月1日)を主張してピリミジン誘導体」とする発明について特許出願(特願平4-164009号)をし、 平成9年5月16日に特許権の設定登録を受けました(特許第2648897号/請求項の数12)。 (b)原告甲Xは、平成27年3月31日、当時の本件特許の請求項1~5及び7~12について、特許無効審判を請求しました(無効2015-800095号)。 (c)丙は、本件審判に、被請求人を補助するため参加を申請し、その許可を受け、原告甲Yは、本件審判に、請求人として参加を申請し、その許可を受けました。 →請求人参加とは (d)被告乙は、平成27年8月3日付け訂正請求書により、特許請求の範囲の訂正を含む訂正を請求しました(請求項3、4、7及び8を削除し、請求項13~17を加えることにより、訂正後の請求項の数を13とするもの)。 (e)特許庁は、平成28年7月5日、「本件審判の請求は、成り立たない。」との審決をし、その謄本は、同月14日、原告らに送達されました。 [特許発明の内容] {特許請求の範囲} 【請求項1】(本件発明1) 式(I): 【化1】 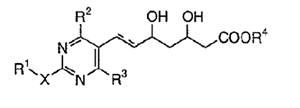 (式中、 R1は低級アルキル; R2はハロゲンにより置換されたフェニル; R3は低級アルキル; R4は水素またはヘミカルシウム塩を形成するカルシウムイオン; Xはアルキルスルホニル基により置換されたイミノ基; 破線は2重結合の有無を、それぞれ表す。) で示される化合物またはその閉環ラクトン体である化合物。 (本件発明2以降を省略) ※イミノ基…アンモニアNH3から水素原子2個を除いた2価の原子団 {産業上の技術分野} 本発明は、3-ヒドロキシ-3-メチルグルタリルコエンザイムA(HMG-CoA)還元酵素阻害剤に関する。さらに詳しくは、コレステロール生合成の律速酵素であるHMG-CoA還元酵素を特異的に阻害し、コレステロールの合成を抑制することにより、高コレステロール血症、高リポタンパク血症、更にはアテローム性動脈硬化症の治療に有効である。 {発明が解決しようとする課題} コレステロールの生成を抑制することによりアテローム性動脈硬化の予防および治療に有用な医薬品を開発することである。 {発明の効果} 本件発明に包含される化合物のHMG-CoA還元酵素阻害作用を、ラット肝ミクロゾーム画分を用いた測定法により測定したところ(【0040】、【0041】)、メビノリンのナトリウム塩の阻害活性を100として、442の相対活性を有していた。 [無効審判請求人甲Xが主張した無効理由] (1) 無効理由1(甲1を主引用例とする進歩性欠如) 本件発明1、2、5、9~12は、甲1(特表平3-501613号公報)に記載された発明(以下「甲1発明」という。)及び甲2(特開平1-261377号公報)に記載された発明(以下「甲2発明」という。以下、枝番のある書証は、特に断らない限り、枝番を全て含む。)並びに本件優先日当時の技術常識に基づいて、特許出願前にその発明の属する技術の分野における通常の知識を有する者(以下「当業者」という。)が容易に発明をすることができた(特許法29条2項)。 (2) 無効理由2(サポート要件違反) 本件発明1、2、5、9~12は、従来技術に比較して顕著に高活性であったとはいえないから、当業者が本件発明の課題を解決できるものと理解できず、特許請求の範囲に記載された特許を受けようとする発明が発明の詳細な説明に記載されたものとはいえない(平成6年法律第116号による改正前の特許法36条5項1号)。 (以下無効理由2を省略) [審決の内容] ア 本件発明1について (ア) 甲1発明 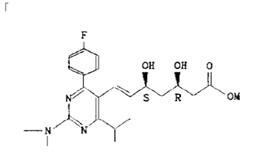 (M=Na)の化合物」 (イ) 本件発明1と甲1発明との一致点及び相違点 【一致点】 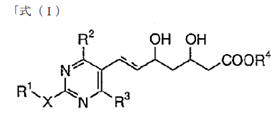 (式中、 R1は低級アルキル; R2はハロゲンにより置換されたフェニル; R3は低級アルキル; 破線は2重結合の有無を、それぞれ表す。) で示される化合物またはその閉環ラクトン体である化合物」である点 【相違点】 (1-ⅰ) Xが、本件発明1では、アルキルスルホニル基により置換されたイミノ基であるのに対し、甲1発明では、メチル基により置換されたイミノ基である点 (1-ⅱ) R4が、本件発明1では、水素又はヘミカルシウム塩を形成するカルシウムイオンであるのに対し、甲1発明では、ナトリウム塩を形成するナトリウムイオンである点 (ウ) 相違点の判断 a 相違点(1-ⅰ)について (a) 甲1発明からの動機付けについて 甲1発明は、甲1の特許請求の範囲に記載される 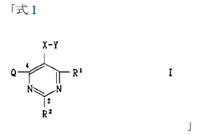 において、「R1」として「不斉炭素を含まぬC1~6アルキル」である「イソプロピル」を選択し、「R2」として「-N(R8)2、但し、R8は独立に、不斉炭素原子を含まぬC1~4アルキル」である「メチル」を選択し、「Q」として「Q”」の「Q”a」、すなわち、 . 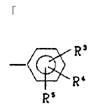 」を選択し、その「R3」、「R4」、「R5」のうち、二つが「水素」、一つが「フルオロ」を選択し、「X」として「ビニレン」を選択し、「Y」として「 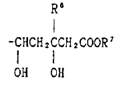 」の「R6」の「水素」、「R7」の「カチオン」である「ナトリウムイオン」を選択したものといえる。 また、甲1発明の化合物は、実施例1b)で得られたものであるから、「HMG-CoA還元酵素」を阻害する薬理活性を有することがデータで裏付けられているものである。一方、甲1の特許請求の範囲に記載される式Iで示される化合物は、甲1発明と同様の薬理活性を有することが全ての範囲で裏付けられているわけではないが、そのような薬理活性が一応期待される化合物として記載されているものといえる。 そこで、本件発明1と甲1の特許請求の範囲に記載された式Iとの関係をみると、本件発明1は、上記式Iの「R2」として「-N(R8)2」を選択し、さらに、「R8」が甲1発明のように「不斉炭素原子を含まぬC1~4アルキル」である「メチル」ではなく、一方の「R8」としてアルキルスルホニル基(-SO2R’;R’はアルキル基)を選択したものといえるが、このような置換基を選択した化合物は、上記式Iの範囲に含まれてはいない。 そうすると、甲1の式Iに含まれない化合物については、「HMG-CoA還元酵素活性」を阻害する薬理活性を期待することができるとはいえないから、甲1発明の「ジメチルアミノ基」を、式Iの範囲に含まれない選択肢である「-N(CH3)(SO2R’)」に置き換える動機付けがあるとはいえない。 (b) 甲2発明からの動機付けについて 甲2には、「一般式 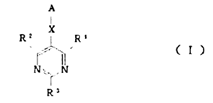 」において、「R1」として「アルキル」を、「R2」として「アリール」を、「R3」として「-NR4R5」で、「R4」、「R5」として「アルキル」、「アルキルスルホニル」を、「X」として「-CH=CH-」を、「A」として「 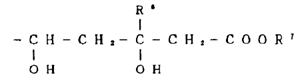 」で「R6」として「水素」、「R7」として「カチオン」を、それぞれ選択肢として含むことが記載され、さらに、「一般式(I)の殊に好ましい化合物」として、「R1」として「イソプロピル」を、「R2」として「フェニル」で「フッ素」で一置換されたものを、「R3」として「-NR4R5」で、「R4」、「R5」として「メチル」、「メチルスルホニル」を、それぞれ選択肢として含むことも記載され、「R7」として「カルシウムカチオン」を、選択肢として含むことも記載されている。 甲2の一般式(I)の化合物も、HMG-CoA還元酵素阻害剤を提供するものであって、甲1の式Iの化合物と同様、ピリミジン環を基本骨格とし、そのピリミジン環の2、4、6位に置換基を有する化合物である点で共通するものであって、選択する置換基によっては、両者に含まれる化合物が一部重複することもあるが、甲1の式Iの化合物と甲2の一般式(I)の化合物は、前記ピリミジン環の置換基の選択範囲が全て一致しているわけではなく、それぞれ、別個の化学構造式を有する化合物として特定され、その化学構造式の化合物であることを前提にHMG-CoA還元酵素阻害剤となり得ることが記載されているものといえる。 そして、化合物の構造が異なれば、そのHMG-CoA還元酵素阻害作用が同じになるとはいえないから、甲1発明のジメチルアミノ基の上位概念として、甲2の一般式の「R3」の「-NR4R5」が対応するとしても、甲1発明のジメチルアミノ基を甲1に開示のない置換基に、甲2の記載に基づいて置換する動機付けがそもそもあるとはいえない。 加えて、甲2の一般式(I)の化合物における「R1」、「R2」、「R3」は、それぞれ極めて多数の選択肢があるところ、少なくとも「X」と「A」が甲1発明と同じ構造として具体的に実施例として記載されているのは、実施例8の「メチルエリスロ-(E)-3、5-ジヒドロキシ-7-[2、6-ジメチル-4-(4-フルオロフェニル)-ピリミド-5-イル]-ヘプト-6-エノエート」(R3がメチル)、実施例15の「メチルエリスロ(E)-3、5-ジヒドロキシ-7-[4-(4-フルオロフェニル)-6-メチル-ピリミド-5-イル]-ヘプト-6-エノエート」(R3がフェニル)、実施例23の「メチルエリスロ-(E)-3、5-ジヒドロキシ-7-[4-(4-フルオロフェニル)6-イソプロピル-2-フェニル-ピリミド-5-イル]-ヘプト-6-エノエート」(R3がフェニル)のみであって、「R3」として「-NR4R5」を選択したものは一つも記載されていない。さらに、「-NR4R5」が置換した化合物については、その製造方法もHMG-CoA還元酵素阻害活性の薬理試験も記載されておらず、「-NR4R5」において、「R4」、「R5」として「メチル」と「メチルスルホニル」という特定の組合せを選択することの記載もない。 そうすると、甲2に記載される一般式(I)の「R3」として、極めて多数の選択肢の中から可能性として考え得る置換基というだけの「-NR4R5」で、「R4」、「R5」として「メチル」と「メチルスルホニル(SO2CH3)」を選択した化合物が、そもそも技術的な裏付けをもって記載されているともいえず、この記載に基づいて、甲1発明の「ジメチルアミノ基」を、「-N(CH3)(SO2CH3)」に置き換える動機付けがあるとはいえない。 (c) 技術常識に基づく動機付けについて 甲7、10、11の記載からすると、コレステロールは肝臓で大部分が合成され、HMG-CoA還元酵素阻害剤がこのコレステロールの生合成を阻害するものであるから、副作用を考慮して肝臓の選択性が高いHMG-CoA還元酵素阻害剤を得ようとすることは、本件優先日当時の技術課題として当業者が認識し得るものとなっていたということはできる。 次に、甲7、20の記載からは、例外はあるとしても、HMG-CoA還元酵素阻害剤において親水性の化合物が、肝選択性を高める可能性があることが示唆されているといえ、肝臓の選択性が高いHMG-CoA還元酵素阻害剤を得るために、HMG-CoA還元酵素阻害活性を示す化合物を、親水性という指標で評価し、親水性の高い(logPが2以下の)化合物を選択するという動機付けは本件優先日当時の当業者が認識できたものと一応認めることができる。 その一方、甲7、20とも、HMG-CoA還元酵素阻害活性がある化合物の親水性を評価したものであるが、HMG-CoA還元酵素阻害活性を示す化合物を親水性とするために、どのような化学構造とすればよいのかについては何ら記載されていない。 甲9には、対象とする化合物のlogP値を理論的に計算できることと、特定の置換基に対応したπx値が示され、合成しようとする化合物の相対的脂溶性などを予測することが可能になることが記載され、RとXを置換基とする芳香族置換体において、Xが「3-SO2CH3」(メチルスルホニル基)のπx値が-1.26であることが示されているが、化合物を親水性にするためにメチル基をメチルスルホニル基に変換するという化合物の改変手段が記載されているわけではないし、ここで示されるメチルスルホニル基は芳香族環に直接置換されるものであって、ピリミジン環にアルキルスルホニル基により置換されたイミノ基(-N(CH3)(SO2CH3)を含む)が置換されている本件発明1とは異なる構造のものである。 そうすると、既にHMG-CoA還元酵素阻害活性があることが分かっている化合物の親水性を測定し、その中から親水性の高い化合物を選択するという動機付けはあるとしても、甲1発明の特定の置換基を別の置換基に置き換えれば、必ずしもHMG-CoA還元酵素阻害活性を保持するかは分からないのであるから、そもそも、メチルスルホニル基を有する化合物のlogP値が小さくなる(親水性となる)ことのみを根拠として、甲1発明において、親水性とするために、その特定の置換基をメチルスルホニル基と置き換える動機付けがあるとはいえない。 また、医薬化合物の開発において、特定の薬理活性を有する化合物の構造を少しずつ変えてその作用を調べることが一般的に行われているとはいえるが、化学構造の変化によってどのような薬理作用の変化が生じるかは不明である以上、甲1発明の化学構造を改変して親水性のHMG-CoA還元酵素阻害剤となる化合物を得ようとするのであれば、少なくともHMG-CoA還元酵素阻害活性が保持される範囲内で親水性となる化合物を得るのが自然である。 甲16は、ピリジン及びピリミジン置換3、5-ジヒドロキシ-6-ヘプテン酸のラクトンを合成し、HMG-CoAに対する阻害活性について構造-活性の関連性を調査した論文であって、そこには、以下の構造式(略)において、中央の芳香族環(ピリミジン環)の2、4及び6位における置換が強力な生物活性をもたらすこと、6位(R1)にイソプロピル基を導入すれば生物活性は最大になること、4位(R2)の極性置換基は4-クロロフェニル及び4-フルオロフェニルが強力な阻害剤となること、2位(R3)の置換は最適な生物活性のために最も重要で、嵩高のアルキル基の導入のみならずフェニル部分の導入によって力価の顕著な上昇が得られることが記載されている。 そうすると、甲16の記載に接した当業者であれば、甲1発明と同様のピリミジン環の6位がイソプロピル基で、4位が4-フルオロフェニル基で置換された化合物の2位の置換基は嵩高いアルキル基やフェニル環が高い阻害活性を示し、甲1の式Iの「R2」として、「不斉炭素原子を含まぬC1~C6アルキル」を選択できることと合わせみて、甲1発明の「ジメチルアミノ基」を、アルキル基やフェニル環に置換することはあっても、甲1、16に何ら記載のない「-N(CH3)(SO2R’)」に置き換える動機付けがあるとはいえない。また、甲1や甲16と関係のない甲2の記載に基づいて、その中から「-N(CH3)(SO2CH3)」を選択することを想起するともいえない。さらに、甲16には、中央の芳香族環(ピリミジン環)の2位における嵩高の親油性の置換基が合成HMG-CoA還元酵素阻害剤の生物活性に寄与していることが記載されているのであるから、そもそも、甲1発明を親水性にするための置換基や置換部位について何らかの示唆があるものとも認めることができない。 甲2は、本件優先日前に存在するメチルスルホニル基を置換基として有する化合物の検索結果が記載され、甲30にもメチルスルホニル基を置換基として有する化合物が記載されているが、これらはHMG-CoA還元酵素阻害剤であるかも不明であって、また、メチルスルホニル基を置換基とすることでその化合物がどのような性質となるのかも記載されていないから、単に、メチルスルホニル基を置換基として有する化合物が本件優先日前に存在していたからといって、甲1発明のジメチルアミノ基を改変し、そのメチル基をメチルスルホニル基とすることが容易に想到できるわけではない。 さらに、本件優先日前に頒布されたその他の証拠をみても、メチルスルホニル基とメチル基を置き換えることの技術的意義についての記載すらなく、甲1発明の化合物を親水性とするために、甲1発明の2位の「ジメチルアミノ基」を「-N(CH3)(SO2R’)」とすることを動機付ける記載は見当たらない。 そうすると、仮に、甲1発明の化学構造を改変して親水性の化合物を得ることを当業者が想起したとしても、甲1発明の化合物を親水性とするために、特定の位置(ピリミジン環の2位)に存在する「ジメチルアミノ基」の一方のメチル基のみをメチルスルホニル基(アルキルスルホニル基)に置き換え、「-N(CH3)(SO2R’)」とする動機付けがあるとはいえない。 (d) 小括 したがって、甲1発明において、相違点(1-i)の構成を採用することが当業者にとって容易であったということはできないから、相違点(1-ⅱ)について検討するまでもなく、本件発明1は、甲1発明及び甲2発明並びに本件優先日当時の技術常識に基づいて当業者が容易に発明をすることができたということはできない。 [取消事由] 1 取消事由1(進歩性の判断の誤り) (1) 動機付けがないとの判断の誤り ア 甲1からの動機付け (ア) 甲1発明の化合物(甲1の実施例1b)の化合物)と本件発明化合物の構造は、下図のとおりであり、その相違点(赤枠部分)は、ピリミジン環の2位のN原子の置換基が、メチル基かメチルスルホニル基かだけである(ナトリウム塩かカルシウム塩かの違いもあるが、この違いは、本件発明化合物の進歩性に何ら寄与しない。)。 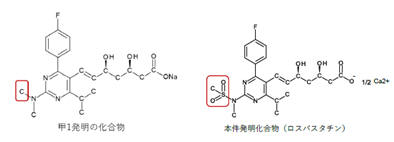 (イ) 甲1発明の化合物は、ヒト患者で有用性が確認されたコンパクチンの約125倍、本件優先日当時コレステロールを低下させる薬剤として販売されていたメビノリン(ロバスタチン)の約15倍という、優れたin vivo活性を有する(甲1の11頁右下欄21行目~12頁左上欄6行目に記載されている試験B(in vivo動物実験試験))。 ※in vivo…“生体内で”という意味で、マウスなどの実験動物を用い、生体内に直接被験物質を投与し、生体内や細胞内での薬物の反応を検出する試験のこと in vitro(試験管内で)という意味と対する。 したがって、当業者が、甲1発明の化合物をリード化合物とする動機付けがあった。 ※リード化合物…創薬過程の出発点となる創薬標的(新薬候補化合物) のこと (ウ) 本件優先日当時、副作用を考慮して肝臓選択性の高いHMG-CoA還元酵素阻害剤を得ようとすることが認識されており、当業者が、リード化合物である甲1発明の化合物の親水性を高めることにより、HMG-CoA還元酵素阻害剤の標的臓器である肝臓へ化合物を選択的に移行させるために、親水性の置換基を導入する動機付けがあった。 そして、本件優先日当時の技術常識を考慮すると、甲1発明の化合物に親水性の置換基を導入するには、ピリミジン環の2位への導入が必然であり、当業者は、甲1発明の化合物のピリミジン環の2位に親水性の置換基を導入する動機付けがあった。 すなわち、甲1発明の化合物は、下図のとおりであるところ、ピリミジン環5位のジヒドロキシヘプテン酸は活性に必須のいわゆるファーマコフォアである(甲15)から、当業者はこの部分の変換は考えない。 また、ピリミジン環4位のp-フルオロフェニル基及び6位のイソプロピル基の組合せで強い活性が得られていること(甲16の「Table Ⅰ」の化合物2t~2wと2r~2sの比較、甲26、27、76)、当時開発されていた化合物の多くがこの組合せを有していたこと(甲8)を考えると、当業者は、ピリミジン環の4位及び6位の変換も考えない。 したがって、当業者は、甲1発明の化合物のピリミジン環の2位に親水性の置換基を導入する。 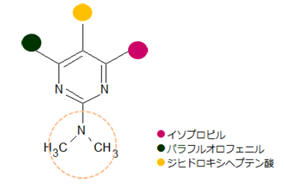 (破線で囲んだジメチルアミノ基はピリミジン環の2位に結合し、パラフルオロフェニル基はピリミジン環の4位に結合し、ジヒドロキシヘプテン酸はピリミジン環の5位に結合し、イソプロピル基はピリミジン環の6位に結合している。) (エ)a リード化合物を改変する際には、リード化合物の化学構造をできるだけ維持しながら少しずつ改変することが原則であるから(甲56~58)、甲1発明の化合物のピリミジン環の2位に親水性の置換基を導入することを考えた当業者は、改変による構造変化ができるだけ小さくなるように、甲1発明の化合物のピリミジン環の2位のジメチルアミノ基の一方のメチル基(CH3)のみを親水基に置換する。 b メチルスルホニル基が最も親水性に寄与する置換基であることは公知である(例えば、甲9、28、56、59、60)から、甲1発明の化合物のピリミジン環の2位のジメチルアミノ基の一方のメチル基をメチルスルホニル基に置換することは容易である。 |
| [裁判所の判断] |
|
(1)裁判所は、進歩性を否定する根拠となる先行技術に関して次のような判断基準を説示しました。 進歩性に係る要件が認められるかどうかは、特許請求の範囲に基づいて特許出願に係る発明(以下「本願発明」という。)を認定した上で、同条1項各号所定の発明と対比し、一致する点及び相違する点を認定し、相違する点が存する場合には、当業者が、特許時(又は優先権主張日。以下「3 取消事由1について」において同じ。)の技術水準に基づいて、当該相違点に対応する本願発明を容易に想到することができたかどうかを判断することとなる。 このような進歩性の判断に際し、本願発明と対比すべき同条1項各号所定の発明(以下「主引用発明」といい、後記「副引用発明」と併せて「引用発明」という。)は、通常、本願発明と技術分野が関連し、当該技術分野における当業者が検討対象とする範囲内のものから選択されるところ、同条1項3号の「刊行物に記載された発明」については、当業者が、特許時の技術水準に基づいて本願発明を容易に発明をすることができたかどうかを判断する基礎となるべきものであるから、当該刊行物の記載から抽出し得る具体的な技術的思想でなければならない。そして、当該刊行物に化合物が一般式の形式で記載され、当該一般式が膨大な数の選択肢を有する場合には、当業者は、特定の選択肢に係る具体的な技術的思想を積極的あるいは優先的に選択すべき事情がない限り、当該刊行物の記載から当該特定の選択肢に係る具体的な技術的思想を抽出することはできない。 したがって、引用発明として主張された発明が「刊行物に記載された発明」であって、当該刊行物に化合物が一般式の形式で記載され、当該一般式が膨大な数の選択肢を有する場合には、特定の選択肢に係る技術的思想を積極的あるいは優先的に選択すべき事情がない限り、当該特定の選択肢に係る具体的な技術的思想を抽出することはできず、これを引用発明と認定することはできないと認めるのが相当である。 この理は、本願発明と主引用発明との間の相違点に対応する他の同条1項3号所定の「刊行物に記載された発明」(以下「副引用発明」という。)があり、主引用発明に副引用発明を適用することにより本願発明を容易に発明をすることができたかどうかを判断する場合において、刊行物から副引用発明を認定するときも、同様である。 したがって、副引用発明が「刊行物に記載された発明」であって、当該刊行物に化合物が一般式の形式で記載され、当該一般式が膨大な数の選択肢を有する場合には、特定の選択肢に係る具体的な技術的思想を積極的あるいは優先的に選択すべき事情がない限り、当該特定の選択肢に係る具体的な技術的思想を抽出することはできず、これを副引用発明と認定することはできないと認めるのが相当である。 そして、上記のとおり、主引用発明に副引用発明を適用することにより本願発明を容易に発明をすることができたかどうかを判断する場合には、 ①主引用発明又は副引用発明の内容中の示唆、技術分野の関連性、課題や作用・機能の共通性等を総合的に考慮して、主引用発明に副引用発明を適用して本願発明に至る動機付けがあるかどうかを判断するとともに、 ②適用を阻害する要因の有無、予測できない顕著な効果の有無等を併せ考慮して判断することとなる。 特許無効審判の審決に対する取消訴訟においては、 上記①については、特許の無効を主張する者(特許拒絶査定不服審判の審決に対する取消訴訟及び特許異議の申立てに係る取消決定に対する取消訴訟においては、特許庁長官)が、 上記②については、特許権者(特許拒絶査定不服審判の審決に対する取消訴訟においては、特許出願人)が、 それぞれそれらがあることを基礎付ける事実を主張、立証する必要があるものということができる(→要件事実論とは)。 (2)裁判所は、上記判断基準を本件で引用された先行技術に対して次のようにあてはめました。 ①主引用発明の選択について 本件発明は、コレステロール生合成の律速酵素である3-ヒドロキシ-3-メチルグルタリルコエンザイムA(HMG-CoA)還元酵素を特異的に阻害し、コレステロールの合成を抑制することにより、高コレステロール血症、高リポタンパク血症、更にはアテローム性動脈硬化症の治療に有効な、HMG-CoA還元酵素阻害剤に関するものであり、甲1発明も、コレステロール生合成における律速酵素である3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)の拮抗阻害剤であって、血中コレステロールレベルを降下させる過脂肪蛋白血症処置剤及び抗アテローム性動脈硬化剤に関するものであるから、本件発明と技術分野を共通にし、本件発明の属する技術分野の当業者が検討対象とする範囲内のものであるといえる。 ②副引用発明(甲2発明)について 甲2には、一般式(I)で示される化合物のうちの「殊に好ましい化合物」のピリミジン環の2位の置換基R3の選択肢として「-NR4R5」が記載されるとともに、R4及びR5の選択肢として「メチル基」及び「アルキルスルホニル基」が記載されている。 しかし、甲2に記載された「殊に好ましい化合物」におけるR3の選択肢は、極めて多数であり、その数が、少なくとも2000万通り以上あることにつき、原告らは特に争っていないところ、R3として、「-NR4R5」であってR4及びR5を「メチル」及び「アルキルスルホニル」とすることは、2000万通り以上の選択肢のうちの一つになる。 また、甲2には、「殊に好ましい化合物」だけではなく、「殊に極めて好ましい化合物」が記載されているところ、そのR3の選択肢として「-NR4R5」は記載されていない。 さらに、甲2には、一般式(I)のXとAが甲1発明と同じ構造を有する化合物の実施例として、実施例8(R3はメチル)、実施例15(R3はフェニル)及び実施例23(R3はフェニル)が記載されているところ、R3として「-NR4R5」を選択したものは記載されていない。 そうすると、甲2にアルキルスルホニル基が記載されているとしても、甲2の記載からは、当業者が、甲2の一般式(I)のR3として「-NR4R5」を積極的あるいは優先的に選択すべき事情を見いだすことはできず、「-NR4R5」を選択した上で、更にR4及びR5として「メチル」及び「アルキルスルホニル」を選択すべき事情を見いだすことは困難である。 したがって、甲2から、ピリミジン環の2位の基を「-N(CH3)(SO2R’)」とするという技術的思想を抽出し得ると評価することはできないのであって、甲2には、相違点(1-ⅰ)に係る構成が記載されているとはいえず、甲1発明に甲2発明を組み合わせることにより、本件発明の相違点(1-ⅰ)に係る構成とすることはできない。 ③従って、原告らの請求を棄却し、主文の通り判決する旨の判決が出されました。 |
| [コメント] |
|
①本件は、本件特許発明と主引用例との相違点に関して、副引用例において選択肢として開示されている場合において、その組み合わせが膨大であるときには、 特定の選択肢に係る技術的思想を積極的あるいは優先的に選択すべき事情がない限り、 当該特定の選択肢に係る具体的な技術的思想を抽出することはできないと判示したケースです。 本件の場合には、2つの相違点に関する選択肢の組み合わせが2000万通り以上あり、それをいちいち実験して、発明として成立するかどうかを確認するのは現実問題として困難だからです。 実験しなければ結果を予測しにくい化学の分野を対象とする判例と ②外国における進歩性の審査基準として、米国のガイドラインでは、先行技術の開示・示唆・動機付けの有無を問題とするいわゆるTSMテストの他に考慮するべき事柄の一つとして、次のことを挙げています(→TSMテストとは)。 “特定されている予測可能な限られた数の解決策の中から、成功する見込みがあって解決策を選択していること(Obvious to Try)。” 本件判決と対比すると、 “予測可能な限られた数”の部分が“選択肢が膨大”ではないことに “成功する見込み”の部分が“特定の選択肢に係る技術的思想を積極的あるいは優先的に選択すべき事情”に それぞれ対応することが分かります。 |
| [特記事項] |
| 戻る |
今岡憲特許事務所 : 〒164-0003 東京都中野区東中野3-1-4 タカトウビル 2F
TEL:03-3369-0190 FAX:03-3369-0191

営業時間:平日9:00~17:20
今岡憲特許事務所TOPページ | はじめに | 特許について | 判例紹介 | 事務所概要 | 減免制度 | リンク | 無料相談
Copyright (c) 2014 今岡特許事務所 All Rights Reserved.

